电解是什么的问题早在高中物理课程中就已经解决了,这对大多数人来说已经不是什么秘密了。另一件事是它的重要性和实际应用。该工艺在各行各业中大有裨益,对家庭工匠很有用。
内容
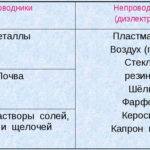
什么是电解?
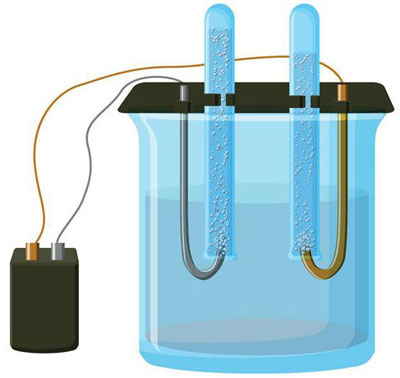
电解是直流电流流过电极和电解质系统中特定过程的复杂过程。其机制基于离子电流的产生。电解质是2型导体(离子电导率) 其中发生电解离解。它涉及分解成带正离子(阳离子) 和负 (阴离子) 收费。
电解系统必然包含一个正极(阳极) 和一个负数 (阴极) 电极。当施加直流电时,阳离子开始向阴极移动,而阴离子向阳极移动。阳离子主要是金属离子和氢,阴离子主要是氧和氯。在阴极,阳离子将多余的电子附着在自身上,从而进行还原反应 Men+ + ne → Me (其中 n 是金属的化合价)。相反,在阳极,电子从阴离子中释放出来,发生氧化反应。
因此,保证了系统中的氧化还原过程。重要的是要记住,要让它发生,需要适当的能量。它必须由外部电流源提供。
法拉第电解定律
伟大的物理学家 M. Faraday 通过他的研究,不仅可以了解电解的性质,还可以对其实施进行必要的计算。 1832 年,他的法律出现,将正在发生的过程的主要参数联系起来。
第一定律
法拉第第一定律指出,在阳极上还原的物质的质量与电解液中感应的电荷成正比:m = kq = k*I*t,其中 q 是电荷,k 是系数或电化学当量物质,I是流过电解质的电流,t是电流流过的时间。

第二定律
法拉第第二定律使得确定比例系数 k 成为可能。其内容如下:任何物质的电化学当量与其摩尔质量成正比,与其化合价成反比。法律表述为:

k = 1/F*A/z其中 F 是法拉第常数,A 是物质的摩尔质量,z 是其化学价。
考虑到这两个定律,我们可以推导出计算沉积在电极上的物质质量的最终公式: m = A*I*t/(n*F)其中n是参与电解的电子数。通常n对应于离子的电荷。从实践的角度来看,将物质的质量与供应的电流联系起来是很重要的,这使得通过改变其强度来控制过程成为可能。
熔体电解
电解的一种选择是使用熔体作为电解质。在这种情况下,电解过程中只涉及熔融离子。一个典型的例子是盐熔体 NaCl 的电解(食盐)。负离子冲向阳极,这意味着气体被释放(氯)。在阴极会发生金属还原,即由吸引过量电子的正离子形成的纯钠沉淀。类似地,可以生产其他金属(钾、钙、锂等) 来自各自盐的熔体。
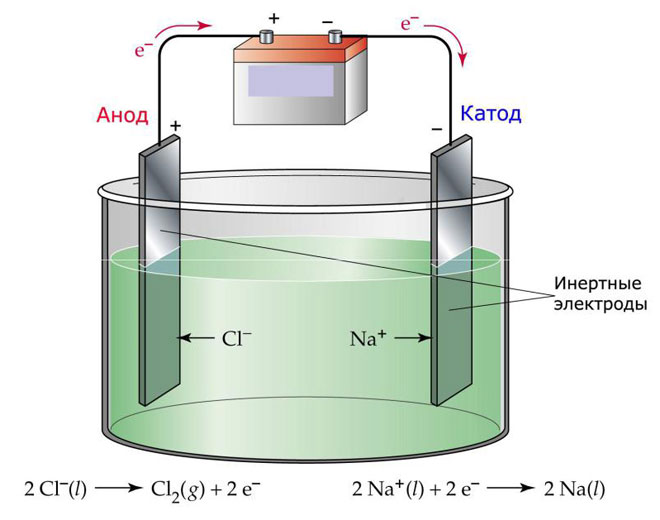
在熔体电解过程中,电极不溶解,而仅作为电流源参与。金属、石墨和一些半导体可用于它们的制造。重要的是材料具有足够的导电性。最常见的材料之一是铜。
溶液中电解的特点
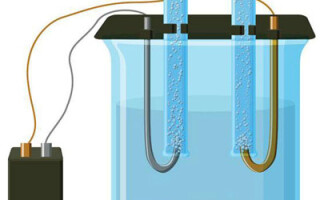
水溶液中的电解与熔体完全不同。有 3 个相互竞争的过程:水的氧化释放氧气、阴离子的氧化和金属的阳极溶解。该过程涉及水离子、电解质和阳极。因此,氢、电解质阳离子和阳极金属的还原可能发生在阴极。

这些竞争过程发生的能力取决于系统的电势。只有需要较少外部能量的过程才会继续进行。因此,具有最大电极电位的阳离子将在阴极被还原,而具有最低电极电位的阴离子将在阳极被氧化。氢的电极电位取为“0”。例如,在钾中它等于(-2,93 В), 钠等于 (-2,71 В), 带领 (-0,13 В),对于银 - (+0,8 В).
气体中的电解
只有在离子发生器存在的情况下,气体才能发挥电解质的作用。在这种情况下,通过电离介质的电流会在电极上引起必要的过程。法拉第定律不适用于气体电解。这些条件是其实现所必需的:
- 如果不对气体进行人工电离,高压和大电流都无济于事。
- 只有气态的无氧酸和一些气体适合电解。
重要的! 如果满足必要条件,则该过程类似于在液体电解质中进行电解。
发生在阴极和阳极的过程的特殊性
对于电解的实际应用,重要的是要了解当施加电流时两个电极会发生什么。以下过程是特征:
- 阴极。带正电的离子冲向它。这是金属还原或氢释放发生的地方。根据它们的阳离子活性可以区分几类金属。 Li、K、Ba、St、Ca、Na、Mg、Be、Al 等金属只能从熔盐中很好地还原。如果使用溶液,由于水的电解而释放出氢气。可以在溶液中提供还原,但具有足够浓度的阳离子,在以下金属中 - Mn、Cr、Zn、Fe、Cd、Ni、Ti、Co、Mo、Sn、Pb。对于 Ag、Cu、Bi、Pt、Au、Hg,该过程是最简单的。
- 阳极。带负电的离子到达该电极。氧化它们,它们从金属中带走电子,导致它们的阳极溶解,即阴离子被转化为带正电的离子,这些离子被导向阴极。阴离子也根据其活性进行细分。只有 PO4、CO3、SO4、NO3、NO2、ClO4、F 阴离子可以从熔体中排出。在水溶液中,它们不经受电解,而是经受释放氧气的水。 OH、Cl、I、S、Br 等阴离子最容易反应。

在提供电解时,重要的是要考虑电极材料的氧化倾向。在这方面,惰性和活性阳极是有区别的。惰性电极由石墨、煤或铂制成,不参与离子的供应。
影响电解过程的因素
电解过程取决于以下因素:
- 电解液的组成.各种杂质的影响很大。它们分为 3 种类型 - 阳离子、阴离子和有机物。物质可能比贱金属或多或少是负面的,这会干扰该过程。有机杂质包括污染物(例如油类)和表面活性剂。它们的浓度有极限值。
- 当前密度.根据法拉第定律,沉积物质的质量随着电流强度的增加而增加。但是,会出现不利的情况 - 集中极化,增加电压,电解液强烈加热。考虑到这一点,每种情况都有电流密度的最佳值。
- 电解质的 pH 值.介质的酸度也是根据金属来选择的。例如,锌的电解液酸度的最佳值为 140 g/cc。
- 电解液温度.它具有模棱两可的效果。随着温度的升高,电解速率增加,但杂质的活性也会增加。每个过程都有一个最佳温度。它通常在38-45度之间。
重要的! 电解可以通过不同的影响和电解液成分的选择来加速或减慢。每个应用程序都有自己的模式,应严格遵守。
电解在哪里使用?
电解用于许多应用。可以确定几个主要用途以获得实际结果。
电镀
可以通过电解施加薄而耐用的金属电镀涂层。将要涂覆的物品作为阴极放入浴中,电解质包含所需金属的盐。这就是钢可以镀上锌、铬或锡的方式。

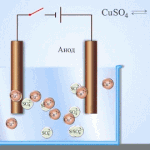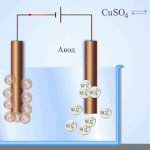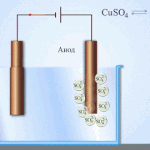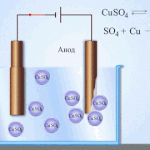
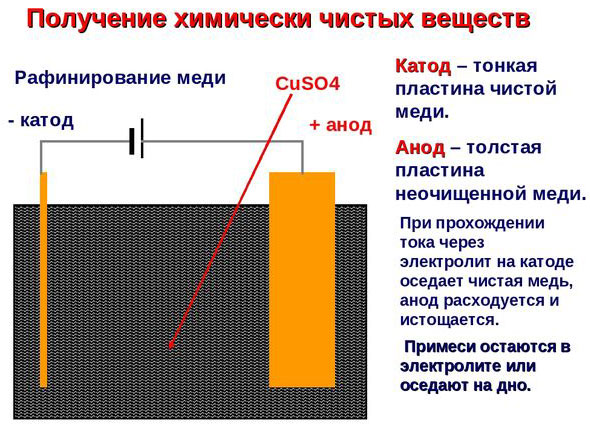
电处理——精炼铜
电炼的一个例子是这个选项: 阴极 - 纯铜, 阳极 - 含杂质的铜, 电解质 - 硫酸铜水溶液。来自阳极的铜变成离子并在没有杂质的情况下沉积在阴极中。
金属提取。
为了从盐中获得金属,将它们转移到熔体中,然后在其中进行电解。这种方法对于从铝土矿、钠和钾中获得铝非常有效。

阳极氧化
在这个过程中,涂层是由非金属化合物制成的。典型的例子是铝阳极氧化。铝部件像阳极一样安装。电解液是硫酸溶液。由于电解作用,在阳极上沉积了一层氧化铝,具有保护和装饰性能。这些技术广泛应用于各个行业。也可以用自己的双手安全地执行这些过程。
能源成本
电解需要大量的能量。如果阳极电流足够,该过程将具有实用价值,为此必须从电源施加相当大的直流电。此外,它还会产生侧电压损耗 - 阳极和阴极过电压,以及由于其电阻而导致的电解液损耗。通过将能量输入的功率与所获得物质的有用质量单位相关联来确定设备的效率。
电解长期以来一直以高效率用于工业。阳极氧化和电镀在日常生活中变得司空见惯,材料的开采和选矿有助于从矿石中提取许多金属。可以通过了解其基本模式来计划和计算该过程。
相关文章: